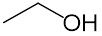
エタノール(Ethanol)とは、実験から消毒液まで多様な役割をこなす物質である。エチルアルコール(Ethyl alcohol)とも呼ばれる。常温常圧では、無色の液体である。
アルコールであることが一目で分かるため、C2H5OHと書かれる。エチル基を表す-Etを用いてEt-OHとも書かれる。
概要
理科の実験に、一度は出てくる物質。日常的には、消毒液や酒、トイレの消臭剤などに含まれている。消毒用には、濃度70%程度のものが使用される。
いわずと知れた、アルコールであり、ビールからチューハイ、ウォッカに焼酎と全ての酒に含まれており、酔いの元となる物質である。引火性があり、火があると燃えるので取り扱いには注意すべきである。 また、内燃機関の燃料として使用することも可能である(IRLなんかに使われている)。
アルコールの中にはメタノールなども含まれるのでアルコール⇒エタノールという解釈は間違っている。
同じアルコールでもメタノールを飲むと失明の危険があるだけでなく、内臓にも悪影響があり最悪死に至るので絶対に飲んではならない。
お酒とエタノール
20歳を超えれば嫌でもお酒を口にすることもあるだろう。しかし、他人に飲酒を強要するのは絶対によくない。
その理由を科学的論理で説明してみる。
体内に摂取されたエタノールは酸化される。酸化されるとアセトアルデヒドという物質になる。
実は酔いには2種類あって、気分の高揚や眠気などいわゆる酩酊の症状はエタノールが原因で、吐き気・目眩、頭痛、顔が赤くなる、などいわゆる悪酔いの感覚はこの物質が原因なのである。
飲んで時間が経つと酔いが冷めて悪酔いの症状が増してくるのは、エタノールが減ってアセトアルデヒドが増えるから。
この物質はさらに体内で酸化され酢酸という物質になり無害となる。酢酸は所謂お酢のことと思ってもらってよい。
酒に強い、アルコールに強い、などとよく言われるが、実はほとんどの日本人はアルコールそのものを分解する能力は個人差こそあれ持っている。
飲んだ次の日になっても気分良く酔っている人がほぼいないのを見れば分かる通り。
しかし、このアセトアルデヒドを酸化し無害の酢酸にする能力は遺伝的で人により大きく異なる。
これが、一般に言う酒の強さである。
お酒に強い人というのはアセトアルデヒドを酸化する能力が優れているので酔いにくい。
逆に弱い人は酸化する能力が劣っているため、アセトアルデヒドが蓄積しやすく悪酔いしやすいのだ。
日本人などモンゴロイドの多くは悪酔いしやすい体質の人が多く、欧米人や南九州人、一部の東北人などは酒に強いと言われている。
ややこしい事に、急性アルコール中毒はエタノールそのものが原因。
エタノールの効果は麻酔に似ていて、大量に摂取すると人体の機能が止まってしまう。
そのため、悪酔いしにくい=酒に強い人でも一度に大量の酒を飲むと急性アルコール中毒で死亡する危険がある。
むしろ、なまじ酒に強い人ほどアセトアルデヒドによる悪酔いが少ない分だけ中毒の危険が高い。
どんな人でも飲み過ぎは厳禁である。
なお、俗に「お酒に慣れると強くなる」と言われているが、その効果はごくわずかしかない。
一方、麻酔と同じようにエタノールはだんだん効きにくくなるので、無理に飲むとアルコール依存症になったり、エタノールだけ効きにくくなってアセトアルデヒド耐性はないまま=鍛えるほど楽しく酔えず悪酔いしかしない、という最悪の情況にもなりうる。
貴方が仮に鍛えて飲めるようになったのなら、それは元から適性があっただけ。
適正がない人間に飲ませるのは拷問に等しい。
お酒を飲む人も飲ませる人も、これらを心の片隅において楽しく飲みましょう。
※エタノールの酸化反応は下に記述してあります。但し、生体的な合成ではないので参考程度に
厚生労働省が健康の為に勧める1日の飲酒限度量(純アルコール量で20g程度)
アルコール中毒の治療
ノックスピン®(ジスルフィラム)、シアナマイド®(シアナミド)という抗酒薬を用いる方法がある。
これらは故意に体内でのアセトアルデヒドの酸化を阻害する。
そのため、これらを服用したあとにお酒を飲むと非常に不快な生理作用(目眩・吐き気・頭痛など)を起こす。
つまり、わざと悪酔いの苦痛を与えてやめさせるという力技の治療法である。
最悪死ぬ場合があるので、厳重な医療監視の下での服用となる。
アルコールと胎児
妊婦が妊娠中にエタノールを摂取すると、体内で生成したアセトアルデヒドが胎児に成長遅延や精神機能低下を引き起こす。さらに、アセトアルデヒドは胎児への体の異常を引き起こす。
従って、妊婦の方は気をつけてください。
化学・熱力学的特性
エタノールはOHをもつので水素結合が出来る。このことは分子量の割に高い沸点を示す原因となっている。分子量の近い物質と比較するとよくわかる。(ジメチルエーテルの沸点が−23.6℃に対してエタノールの沸点が78.4℃)
水と混合すると混合前の総体積より体積が減少することがある。これは水とエタノールが互いに分子間の余分な間隙を埋めあうからである。体積の減少の仕方はモル分率に依存する。
合成
エチレンと水を硫酸触媒中で反応(求電子付加反応)させるこにより合成できる。
C2H4+H2O→C2H5OH
酸化
エタノールはクロム酸H2CrO4と反応(Sn2反応とE2反応を含んだの多段階反応)させると、アセトアルデヒドになり、さらに酸化させると酢酸(エタン酸)になる。
クロム酸を用いると一気に酢酸にまで酸化してしまうのでアセトアルデヒドを合成するには好ましくない方法である。
そこで用いるのがPCC(Pyridinium ChloroChromate)である。PCCの化学式は(C5H5N+H)・ClCrO3-である。以下の反応はジクロロメタン(CH2Cl2)を溶媒とする。
C2H5OH→CH3CHO
反応性
硫酸などの酸触媒を用いてOH基を活性化させると反応を起こす。エタノールは第一級アルコールなのでE2反応を起こしエチレンを生成するか、Sn2反応を起こしてジエチルエーテルを生成する。
エタノールに濃硫酸を触媒とし、130~140℃に加熱すると、Sn2反応が優先しジエチルエーテルが主生成物となる。
2C2H5OH→C2H5OC2H5+H2O
エタノールに濃硫酸を触媒とし、160~170℃に加熱すると、E2反応が優先しエチレンが主生成物となる。
C2H5OH→C2H4+H2O
関連動画
関連商品
関連コミュニティ
関連項目
親記事
子記事
- なし