Standard elektrodepotensial (\(E^{\circ}\)) avledes fra standard Gibbs fri energi (\(\Delta G^{\circ}\)) ved hjelp av følgende ligning:
\[\Delta G^{\circ} = -nFE^{\circ}\]
Her er nF antall Faraday, eller ladningsmengden som overføres i reaksjonen. Elektrodereaksjonene er ordnet som reduksjonsreaksjoner i spenningsrekken, slik at de edleste metallene kommer øverst i tabellen. Tilhørende verdier for standard elektrodepotensial finnes i tabeller.
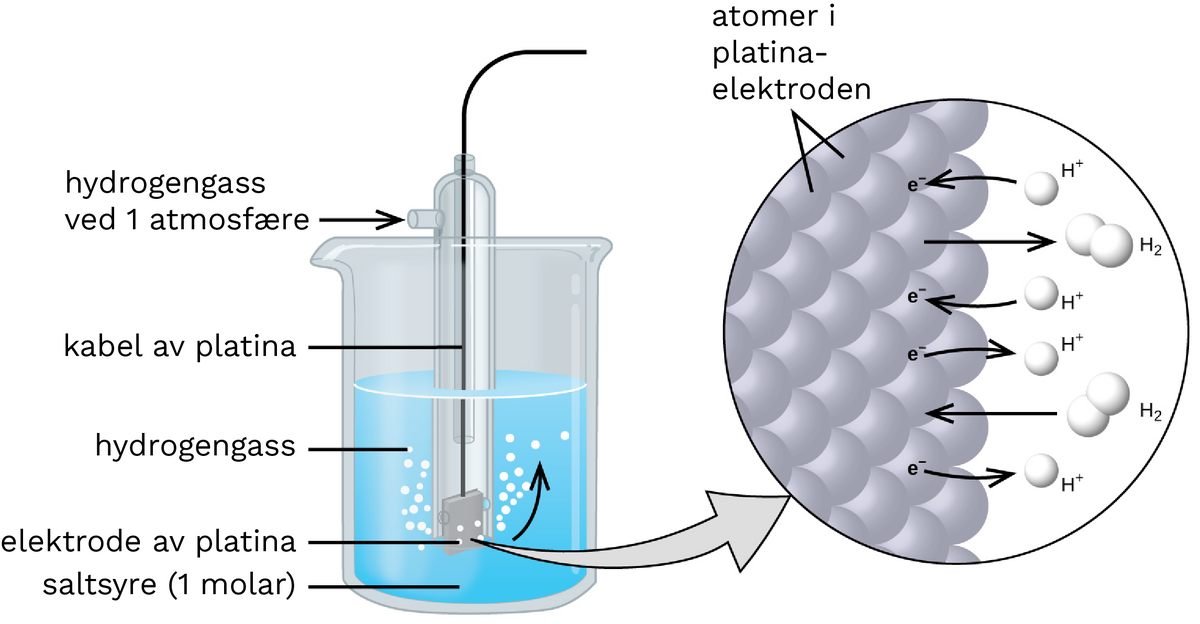
Hydrogenelektroden er utgangspunktet for spenningsrekken i vandige elektrolytter. Den har et standard elektrodepotensial lik null for alle temperaturer.
\[\ce{2H+ (aq) + 2e^{-}} = \ce{H2 (g)}\]
Verdier for standardpotensialer for totalreaksjoner (nøytrale reaksjoner) kan beregnes ved å kombinere to elektrodereaksjoner, og en kan da vurdere kvalitativt hvilke reaksjoner som vil være mulige. I andre elektrolytter som saltsmelter brukes også standard elektrodepotensialer beregnet fra standard Gibbs energi. Imidlertid er hydrogenelektroden ikke en elektrode som er praktisk til bruk i saltsmelter.





Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.