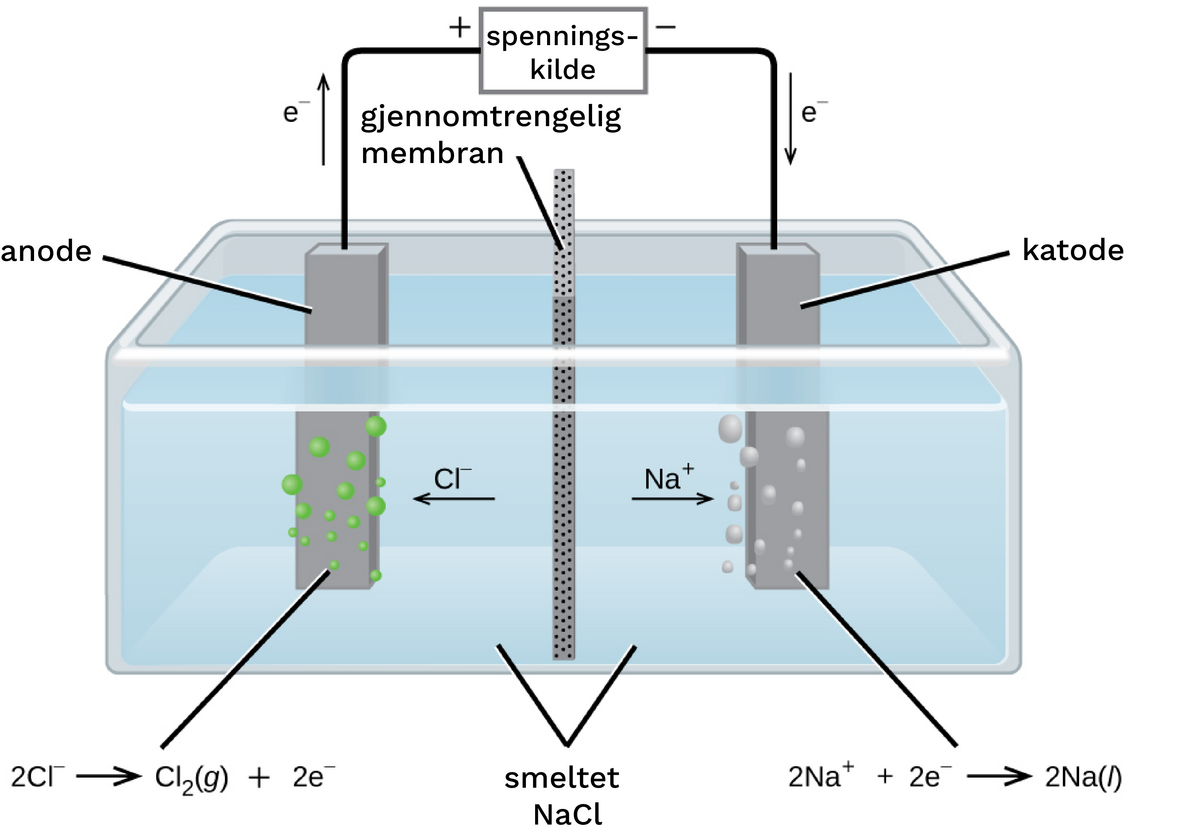
Klor/alkali-elektrolyse er verdens største elektrolyseprosess hvor produktene klorgass og natriumhydroksid (NaOH) eller natronlut blir produsert i en elektrolytt med natriumklorid oppløst i vann. Årsproduksjonen er 62 millioner tonn klorgass og 58 millioner tonn natriumhydroksid.
Klorgass er svært reaktiv og giftig. Den brukes til desinfisering av vann og produksjon av PVC. I tillegg brukes klor til syntese av organiske forbindelser som benyttes til framstilling av blant annet medisiner.
Natriumhydroksid løses lett i vann og danner natronlut som er svært basisk og sterkt etsende. Den brukes til rensing av tilstoppede rør og i framstilling av aluminiumoksid fra bauxitt som er råstoff for produksjon av aluminium.
I Norge er det fabrikker for klor/alkali-elektrolyse ved INEOS Rafnes AS og AS Borregård Sarpsborg.
Katoden er av stål og forbrukes ikke under hydrogenutvikling. Anoden var tidligere karbon i form av grafitt. Men en bedre anode er utviklet og brukes i denne industrien i dag. Den er basert på titan med et belegg av titanoksid og rutenoksid, og denne anoden kalles DSA (dimensjonsstabil anode), det vil si at den ikke forbrukes under klorutvikling slik at den ikke endrer geometri og den har veldig lang brukstid. DSA-anoden virker også katalytisk for klorutviklingsreaksjonen slik at oksygenutvikling skjer i svært liten grad.
På grunn av hydrogenutvikling på katoden, vil elektrolytten bli mer basisk under elektrolyse. Derfor er det nødvendig å bruke en skillevegg eller en membran for å unngå at elektrolytten ved anoden blir mer basisk slik at klorgass blir hovedproduktet på anoden. I en mer basisk løsning vil klorgass reagere med elektrolytten og danne oppløselige klorforbindelser. I katoderommet vil konsentrasjonen av natriumhydroksid øke under elektrolyse, og natriumhydroksid i fast form blir produsert ved å ta ut elektrolytt som varmes opp slik at vannet fordamper. Elektrodereaksjonene og totalreaksjonen er som følger:
Katode: \(\ce{H2O + e^{-} -> \frac 12 H2 + OH^{-}}\)
Anode: \(\ce{Cl^{-} -> \frac 12 Cl2 + e^{-}}\)
Totalreaksjon: \(\ce{NaCl + H2O -> NaOH + \frac 12 H2 + \frac 12 Cl2}\)



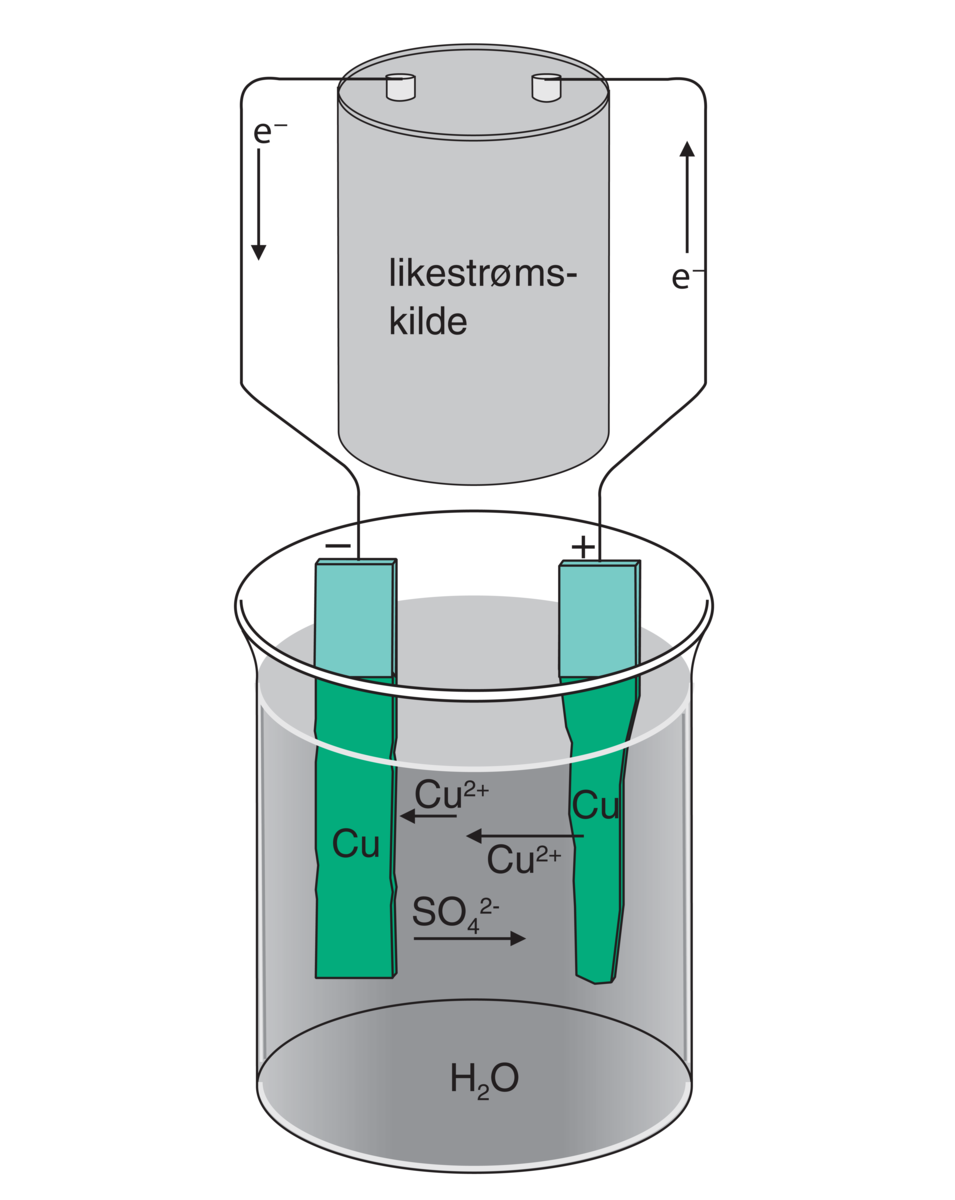

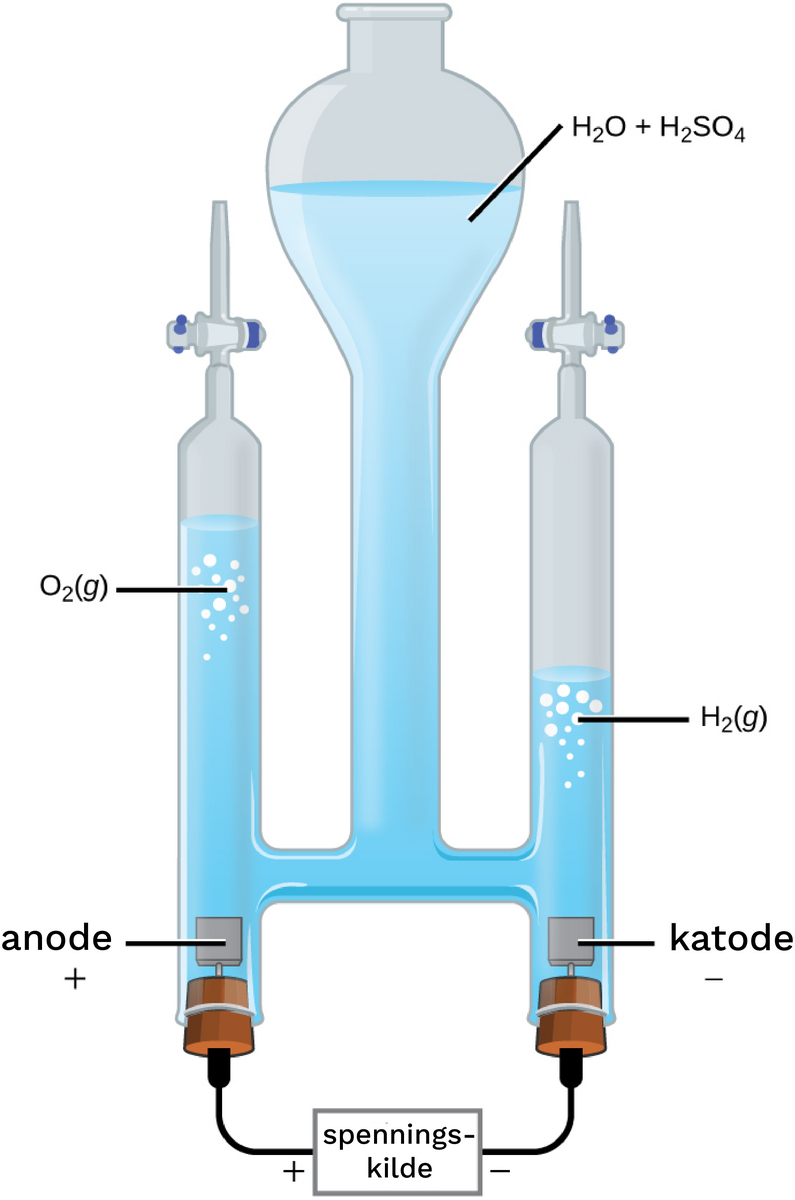
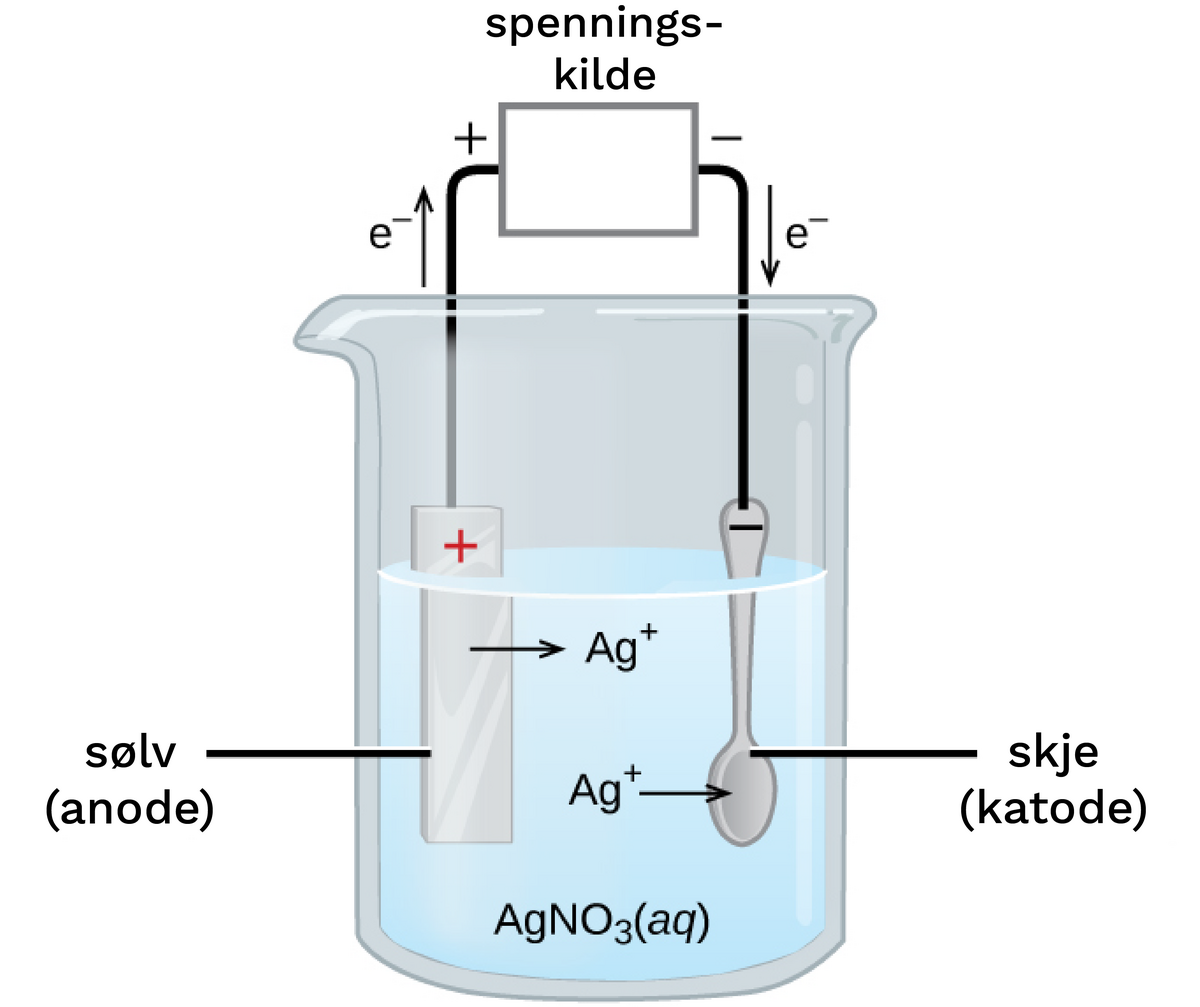


Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.