Amine oxyde

Un[1] amine oxyde ou amine-oxyde, aussi appelé amine-N-oxyde ou simplement N-oxyde et en fait en français "non-chimique", oxyde d'amine ou N-oxyde d'amine, est un composé organique qui contient le groupe fonctionnel R3N+-O−, c'est-à-dire une liaison azote–oxygène avec trois atomes d'hydrogène additionnels ou chaînes carbonées latérales attaché à l'azote. Cette liaison est parfois notée R3N→O ou, de manière erronée, R3N=O.
Dans un sens strict, le terme "amine oxyde" ne s'applique qu'aux oxydes d'amines tertiaires. Cependant, il est parfois aussi utilisé pour les dérivés analogues d'amines primaires et secondaires.
Des exemples d'amine oxyde sont le pyridine-N-oxyde, un solide cristallin, soluble dans l'eau avec un point de fusion de 62 à 67 °C et le N-méthylmorpholine-N-oxyde qui est un oxydant
Propriétés
[modifier | modifier le code]Les amines-oxydes sont utilisés comme groupe protecteur d'amines et comme intermédiaires de synthèse. Les amines-oxydes avec de longues chaînes alkyle sont utilisés comme surfactants non ioniques et stabilisateurs de mousse.
Les amines oxydes sont des molécules hautement polaires. Les petits amines-oxydes sont très hydrophiles et ont une excellente solubilité dans l'eau mais au contraire très faible dans la plupart des solvants organiques
Les amines oxydes sont des bases faibles avec un pKa autour de 4,5 et qui forment R3N+-OH, une hydroxylamine cationique, par protonation à un pH plus bas que leur pKa.
Synthèse
[modifier | modifier le code]Les amines-oxydes sont préparés par réaction des amines tertiaires ou des pyridines analogues avec du peroxyde d'hydrogène (H2O2) ou de l'acide de Caro ou des peracides comme l'acide méta-chloroperbenzoïque dans une réaction appelée N-oxydation[2].
Réactions
[modifier | modifier le code]- Élimination pyrolytique
- Quand ils sont chauffés vers 150 à 200 °C, les amines-oxydes éliminent une hydroxylamine ce qui forme un alcène. Cette syn-réaction d'élimination pyrolytique est connue sous le nom de réaction de Cope. Son mécanisme est similaire à celui de l'élimination de Hofmann.
- Réduction en amine
- Les amines oxydes sont facilement convertis en leur amine parent par les réactifs de réduction courants comme l'hydrure d’aluminium et de lithium (LiAlH4), le borohydrure de sodium (NaBH4), les réductions catalytiques ou les paires zinc/acide acétique et fer/acide acétique. Les pyridine-N-oxydes peuvent être désoxygénés par réaction avec du trichlorure de phosphoryle (POCl3).
- O-alkylation
- Les pyridine-N-oxydes peuvent réagir avec des halogénures d'alkyle pour former des produits O-alkylés.
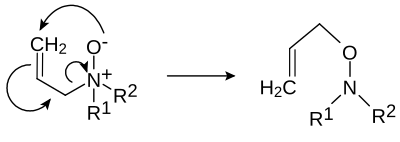
- Réarrangement de Meisenheimer
- (d'après Jakob Meisenheimer (en)) certains N-oxydes, R1R2R3N+O− se réarrangent en hydroxylamines R2R3N-O-R1[3],[4] :
- Dans un réarrangement 1,2:
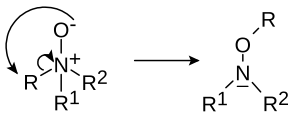
- ou un réarrangment 2,3:
- Réaction de Polonovski
- Un N-oxyde tertiaire est clivé par l'anhydride acétique en l'acétamide correspondant et du formaldéhyde[5],[6],[7]:
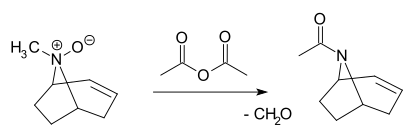
Métabolites
[modifier | modifier le code]Les amines oxydes sont des métabolites courants des médicaments et drogues psychoactifs, par exemple, de la nicotine, du zolmitriptan ou de la morphine.
Ses amines oxydes de produits anti-cancéreux ont été développés comme prodrogues qui sont métabolisées en la molécule active dans les tissus cancereux déficients en oxygène.
Notes et références
[modifier | modifier le code]- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Amine oxide » (voir la liste des auteurs).
- http://www.larousse.fr/encyclopedie/nom-commun-nom/amine-oxyde/20505
- (en) Recent trends in the chemistry of pyridine N-oxides, Shaker Youssif, Arkivoc, 2001, p. 243. Article [PDF]
- J. Meisenheimer, Ber., 1919, vol. 52, p. 1667.
- March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, Michael B., Smith J., March Wiley-Interscience, 5th édition, 2001. (ISBN 0-471-58589-0)
- Grierson, D.;Org. React., 1990, vol. 39, p. 85. DOI 10.1002/0471264180.or039.02.
- M. Polonovski, M. Polonovski, Bull. Soc. Chim. France, 1927, vol. 41, p. 1190.
- Strategic Applications of Named Reactions in Organic Synthesis (Paperback), Laszlo Kurti, Barbara Czako. (ISBN 0-12-429785-4).
Articles connexes
[modifier | modifier le code]- Groupe fonctionnel
- Amine, NR3
- Hydroxylamine, NR2OH
- Phosphine oxyde, PR3=O
- Sulfoxyde, R2S=O
- Azoxy, RN=N+(O−)R ou RN=N+R(O−)
- La sonde radicalaire TEMPO (2,2,6,6-tétraméthylpipéridine-1-oxyl), un amine oxyde radicalaire stable



